据了解,胃癌患者的术后生存评估、化疗反应性预测、对化疗不敏感患者的新药靶点发现是临床胃癌研究面临的三大难题。除胃癌细胞本身癌基因激活和抑癌基因失活等促癌信号变化外,肿瘤微环境中肿瘤浸润免疫细胞的功能表型变化可以通过激活抗肿瘤免疫反应或者诱导肿瘤免疫逃逸参与胃癌发生发展,影响患者术后生存和复发以及对化疗药物的反应性,逐渐成为开发新的胃癌治疗药物的靶点。
肿瘤相关巨噬细胞通过分泌CXCL8诱导自身表达PD-L1介导胃癌免疫逃逸
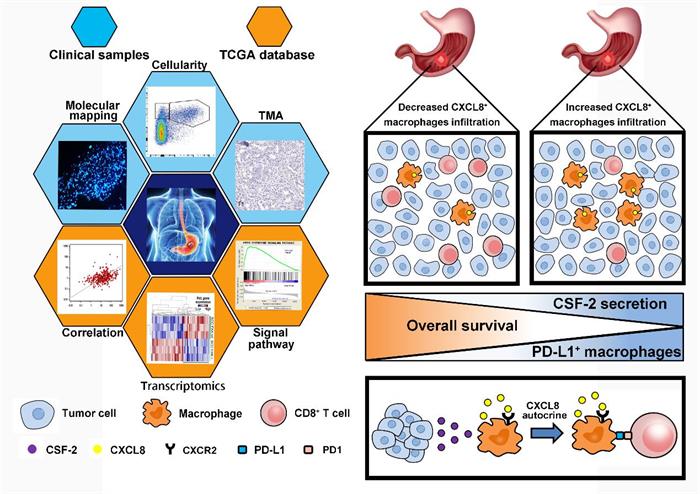
复旦大学基础医学院徐洁杰课题组和中山医院孙益红课题组、秦净课题组围绕胃癌免疫调节与免疫耐受方向展开长期合作,关注肿瘤浸润免疫细胞功能表型变化促进胃癌免疫逃逸形成的细胞和分子机制,在胃癌免疫分型和免疫逃逸形成机制方面开展持续深入的研究,发现胃癌细胞癌基因Notch1激活、抑癌基因GALNT5失活等促癌信号活化以及与肿瘤突变负荷和肿瘤抗原性形成密切相关的O6-甲基鸟嘌呤-DNA甲基转移酶表达,通过改变肿瘤相关巨噬细胞、肿瘤浸润肥大细胞、γδT细胞、Treg细胞、中性粒细胞和IL-17阳性细胞等肿瘤浸润免疫细胞招募活化及其功能表型,影响肿瘤微环境中抗肿瘤免疫反应和肿瘤免疫逃逸参与胃癌发生发展,在胃癌患者术后生存评估和化疗反应性预测中具有重要意义,并为探索新的胃癌免疫治疗靶点奠定理论基础(Br J Cancer. 2014; 110(8): 2021-9. Br J Cancer. 2014; 110(9): 2283-90. Gastric Cancer. 2015; 18(4): 740-50. Br J Surg. 2017; 104(8): 1037-1044. JAMA Surg. 2017; 152(11): e173120. Oncoimmunology. 2017; 6(11): e1353858. Cancer Immunol Immunother. 2018; 67(2): 261-269. Oncoimmunology. 2018; 7(6): e1433517. Ann Surg. 2018; 267(2): 311-318. Ann Oncol. 2018 Nov 15. doi: 10.1093/annonc/mdy505.)。
在本研究中,研究人员通过免疫组化检测发现,趋化因子CXCL8的高表达与胃癌患者的不良预后相关,同时通过流式检测和免疫荧光证实胃癌组织中CXCL8主要来源于肿瘤相关巨噬细胞,并且胃癌微环境细胞因子CSF2能够促进肿瘤相关巨噬细胞分泌CXCL8。进一步分析发现,在胃癌组织中CXCL8的表达与CD8阳性T细胞的浸润和增殖呈负相关,并且CXCL8能够通过诱导肿瘤相关巨噬细胞表达PD-L1从而抑制CD8阳性T细胞的功能活化。而利用CXCL8受体的小分子抑制剂则能显著降低胃癌组织中PD-L1阳性肿瘤相关巨噬细胞的比例,并促进CD8阳性T细胞的增殖活化,从而增强抗肿瘤免疫反应。本研究结果表明,在胃癌患者肿瘤微环境中,肿瘤相关巨噬细胞能够通过分泌CXCL8诱导自身表达PD-L1介导免疫逃逸,促进胃癌发生发展和复发转移。此研究结果为胃癌患者的免疫治疗提供了新思路。
复旦大学附属中山医院林超博士、贺宏勇博士、刘浩博士及复旦大学博士生李若辰为论文的共同第一作者。复旦大学基础医学院徐洁杰、张伟娟和复旦大学附属中山医院孙益红为论文的共同通讯作者。该研究项目得到了国家自然科学基金委和上海市科委等项目的共同资助。





 紫禁城里过大年 乾清宫首次复原立天灯万寿灯场景
紫禁城里过大年 乾清宫首次复原立天灯万寿灯场景
