根据世界卫生组织(WHO)发布的最新统计数据,2022年度全球记录的新发癌症病例数量近两千余万例,癌症造成的死亡病例数约为974万。在男性群体中,肺癌、前列腺癌、结直肠癌位列新发病例数前三;在女性群体中,乳腺癌、肺癌、结直肠癌则是威胁最大的三种癌症类型。
2024年2月,中国科学院院士、国家癌症中心主任赫捷及其团队在《国家癌症中心杂志》上发表了题为“Cancer incidence and mortality in China, 2022”的论文。数据显示,2022年我国新增癌症病例超过480万,相应的死亡病例也超过了250万。其中,肺癌、结直肠癌、甲状腺癌、肝癌及胃癌居于前列,是我国最常见的五大癌症种类。从性别分布来看,男性患者中最常见的三种癌症分别为肺癌、结直肠癌和肝癌;而女性患者中新发病例数最多的三类癌症依次为肺癌、乳腺癌和甲状腺癌。
在全球范围内,癌症已经成为一项亟待解决的重大公共卫生议题。面对这一严峻挑战,社会各界积极展开探索与实践,逐步构建起一套多元化、全方位的治疗应对策略,致力于推动癌症的早期发现与及时治疗,完善和规范诊断与治疗的标准流程,全面提升癌症防控工作的质量和效率。
治疗手段不断进步 新治疗方式持续涌现
自中世纪以来,人类即已踏上与癌症不懈抗争的漫漫长路。在一千多年的历史中,医学界在癌症研究和治疗方法上积累了丰富的成果并实现了重大突破,从最初的依赖手术摘除肿瘤,到后来发展出放化疗、靶向药以及最新的细胞疗法,这些新治疗方式的出现不断提升癌症治疗效果,并提高癌症患者的生活质量。
手术治疗
手术治疗是治疗癌症的传统方法。它是在癌症发生淋巴结或远端转移之前消除多种癌症的最有效方法之一。该方法通过外科手段切除肿瘤组织,尤其适用于实体瘤的治疗。
手术治疗癌症有着自己的优势:首先,通过手术可以直接去除癌症病灶;其次,手术可以有效清除对放射线不敏感或药物难以抵达的肿瘤特殊部位;第三,手术过程中切除的肿瘤组织可用于病理学分析,为医生提供关键信息,以便为特定患者制定最适合的个体化治疗方案。
然而,手术治疗亦存在一定的局限与挑战。一方面,手术无法确保彻底清除肿瘤边缘的所有微小病变,有可能遗留癌细胞导致术后复发;另一方面,患者必须拥有良好的体质以耐受手术本身及麻醉带来的压力;此外,手术过程中难免会对周边正常组织造成一定的损伤,且可能存在诸如感染、出血等手术并发症风险;如果癌症已经发生转移,手术无法清除体内其他部位的转移瘤,此时手术的目的可能转变为缓解症状或减轻肿瘤负荷。
放化疗
化学疗法(简称化疗),是一种利用化学药物对抗癌细胞的全身性治疗方法;放射性治疗(简称放疗),是一种利用高能电离辐射(如X射线、γ射线、α粒子束和电子束等)来消灭肿瘤细胞的治疗方式。
化疗主要针对快速分裂的细胞产生作用,癌细胞增殖速度超过正常细胞,会成为化疗主要针对的细胞类型;放疗则直接利用射线对癌细胞造成杀伤,从而使癌细胞被迫停止增殖直至死亡。随后,机体自身的清除机制会逐步分解和消除这些受损的癌细胞。
随着手术、放化疗技术的发展,目前已形成针对癌症的综合治疗体系。不过随着个性化诊疗及精准医学的发展,近年来更加定制化的癌症治疗方案技术逐步发展,并得到市场认可,不论是靶向治疗还是细胞疗法都取得了不错的进展。
靶向治疗
分子靶向治疗是以癌症相关分子为靶点,将药物、抗体等有效成分精准导向癌细胞及关联成分,旨在提高疗效,减轻毒副作用,因针对性强,已成为全球癌症治疗研究的重点。在该领域中,识别合适的靶点分子对于理论指导与实践应用意义重大。分子靶向治疗通过干预肿瘤细胞在癌变进程中涉及的关键环节,如抑制肿瘤细胞的过度增殖、干扰其不正常的细胞周期进程、诱导肿瘤细胞再分化、抑制肿瘤细胞迁移、启动并促进肿瘤细胞的程序性死亡(即凋亡)等途径达到治疗肿瘤的目的。
在实际应用中,科学家和临床医生已经发现并验证了一系列与肿瘤发生发展密切相关的分子靶点,这些靶点涵盖了多种生物功能类别,如细胞表面受体、细胞内信号传导分子、细胞周期调控分子、血管生成因子等。针对这些靶点研发的分子靶向药物,已经在多种实体瘤和血液系统恶性肿瘤的治疗中取得了显著效果。
细胞疗法
细胞治疗是指采用生物工程的方法获取具有特定功能的细胞并通过体外扩增、特殊培养、定向改造等处理后,使这些细胞具有增强免疫、杀死病原体和肿瘤细胞等功能,从而达到治疗某种疾病的目的。目前主要的细胞治疗方式为免疫细胞治疗和干细胞治疗,其中应用于癌症治疗的主要为免疫细胞治疗。
目前免疫细胞治疗领域引起广泛关注,较为主流的疗法包括TIL疗法、CAR-T疗法、TCR-T细胞疗法、CAR-NK细胞疗法等,不同的疗法在肿瘤治疗中也有着各自的优势。
CAR-T疗法 CAR-T技术是指通过基因工程技术在T细胞内加入嵌合抗原受体,从而形成CAR-T细胞。这种嵌合抗原受体主要由三部分构成:细胞外的单链抗体可变区,负责识别和结合癌细胞表面特定抗原;跨膜区,使得受体能锚定在T细胞膜上;胞内信号转导结构域,负责将抗原结合的信号传递到T细胞内部,激活其效应功能。体表嵌合抗原受体靶向捕捉和结合癌细胞体表的抗原,随后,CAR-T细胞释放细胞因子,通过穿孔素等对癌细胞进行靶向摧毁。
TIL疗法 TIL疗法指从患者身上分离的肿瘤组织中纯化T细胞,采用克隆培养方法体外大量扩增肿瘤杀伤性T细胞,再通过将这些被扩增的T细胞输入患者体内,达到杀伤肿瘤细胞的目的。TIL疗法过程主要包括:通过手术取出肿瘤,并识别和分离肿瘤组织中的免疫细胞;通过加入 IL-2等细胞因子,刺激T细胞增殖体外迅速扩增这些免疫细胞;对增殖后的T细胞进行筛选,留下对肿瘤细胞有免疫反应的克隆型;将扩增的细胞重新输回病人体内,使其识别并清除体内剩余肿瘤细胞。
TCR-T疗法 TCR-T技术通过对T细胞受体进行基因改造,使其对HLA(人类白细胞抗原)呈递的肿瘤新抗原具有更高特异性,从而实现靶向杀死肿瘤细胞的目的。在TCR-T疗法中,经过基因改造添加的受体只能特异性地与MHC(主要组织相容性复合体)蛋白连接。MHC分子将肿瘤抗原递呈给T细胞时,一旦识别到被病毒感染的细胞或肿瘤细胞,杀伤性T细胞能够启动细胞毒性反应,诱导靶细胞发生程序性死亡(细胞凋亡或细胞毒作用),从而及时清除体内的威胁。TCR-T疗法的过程与CAR-T疗法类似,CD8+T细胞被从患者体内分离、激活并通过带有目标基因的病毒载体转导、扩增并重新注入患者体内。经过转导的CD8+T细胞因其表达针对肿瘤特异性抗原的特定TCR受体,能够有效识别肿瘤细胞表面由MHC分子呈递的相应抗原,进而引发针对肿瘤细胞的免疫反应。
CAR-NK疗法 CAR-NK技术通过基因编辑在NK细胞内加入嵌合抗原受体,从而形成具有特异性识别和靶向杀伤肿瘤细胞能力的CAR-NK细胞,能够有效地捕捉并杀死肿瘤细胞,以达到治疗效果。CAR-NK细胞的嵌合抗原受体结构通常也由三部分组成,即胞外抗原结合区(一般为scFv)、跨膜结构域以及胞内激活结构域。CAR-NK细胞的设计理念与CAR-T细胞疗法中使用的CAR结构有异曲同工之处。
中国细胞疗法蓬勃发展 应用前景广阔
近年来,我国持续推出一系列细胞疗法相关政策法规及技术指导原则,系统性规范该领域并积极引导创新发展。逐步完备的监管体系,对细胞疗法的研发、申报、临床试验等各环节提供了详尽规范与指导,确保合规安全,有力推动行业健康发展与技术创新。
2017年,诺华的Kymriah获得美国食品药品管理局(FDA)批准,成为全球首款上市的CAR-T治疗产品,因此2017年也被认为是CAR-T疗法“元年”。Kymriah的上市掀起新一轮细胞疗法的热潮,此后多款免疫细胞疗法获批上市。2024年2月,Iovance的Amtagvi获FDA批准上市,用于晚期黑色素瘤治疗,这是全球首款获批上市的TIL疗法,也是首款获批治疗实体瘤的T细胞疗法,成为细胞疗法的又一里程碑。
随着全球细胞疗法产品的成功获批上市以及我国药品监管制度的逐步完善,国内细胞治疗行业展现出蓬勃生机。无论是创新型企业还是老牌药企,纷纷涉足该领域,合力推进行业繁荣。其中,CAR-T疗法在我国药企的临床管线布局中表现尤为突出,截至2024年4月有近600条相关项目正处于临床阶段。
得益于药品审评审批的流程优化,中国细胞疗法创新药的获批和国外的间隔时间大幅度缩短。在2017年全球首款CAR-T细胞疗法上市之后,仅仅相隔不到四年,中国首款CAR-T细胞疗法就获批上市:2021年6月,复星凯特的阿基仑赛注射液正式在中国获批,用于治疗既往接受二线或以上系统性治疗后复发/难治性大B细胞淋巴瘤成人患者。这是中国首个以药品途径批准上市的CAR-T细胞治疗产品。此后中国CAR-T细胞疗法研发开始加速,截至2024年4月,中国已上市CAR-T细胞疗法数量达到5款,除阿基伦赛外,其他4款分别为药明巨诺的瑞基奥仑赛(CD19)、驯鹿生物的伊基奥仑赛(BCMA)、合源生物的纳基奥仑赛(CD19)和科济药业的泽沃基奥仑赛(BCMA)。
据沙利文报告,全球CAR-T疗法市场规模从2017年的约1000万美元迅速增长到2021年的17.3亿美元,2021—2025年预计将以47%的年复合增长率(CAGR)增长,2025年达到80.3亿美元,并将以21%的CAGR增长到2030年的211.4亿美元。虽然第一个CAR-T产品于2021年才在中国获批上市,但中国市场规模快速增长,预计将从2021年的2000万美元以178%的CAGR增长到2025年的10.9亿美元,预计2030年将达到43.1亿美元,未来市场潜力巨大。(详见图1)
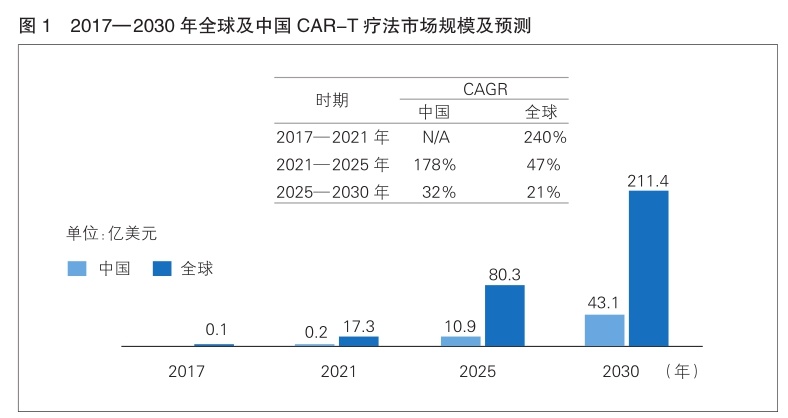
在CAR-T疗法之外,TIL疗法同样受到市场青睐。TIL疗法在实体瘤治疗中有天然优势,具有肿瘤特异性靶点丰富、肿瘤趋向性好、浸润能力强和副作用小等优点。因此在实体瘤治疗中,TIL疗法实体瘤临床管线数量正在迅速增加,在整体实体瘤细胞免疫治疗的占比从2020年的4.5%增加到2022年的17.1%。
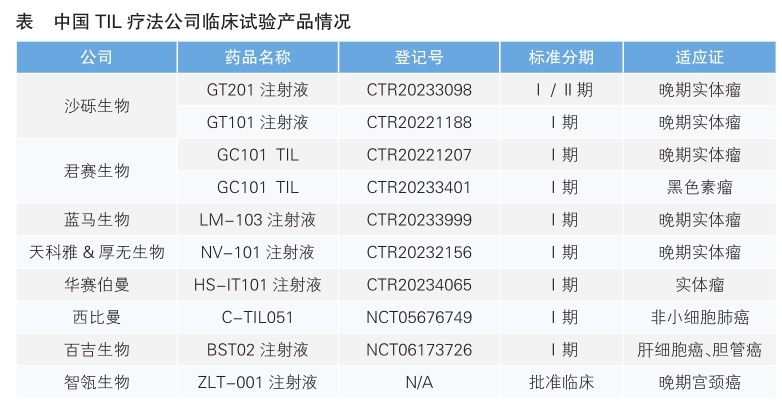
此前,人们就预计Amtagvi有望成为全球首个上市的TIL疗法,而伴随着全球TIL疗法研发的火热,中国TIL疗法研究也如火如荼。2022年4月,沙砾生物自主研发生产的TIL疗法治疗产品GT101注射液(受理号CXSL2200061)获得我国药监部门的临床试验默示许可,成为我国首个进入临床试验的TIL产品。此后,君赛生物、蓝马生物等多家公司的多款TIL疗法也相继进入临床试验,中国TIL疗法开始进入高速发展阶段(详见表)。
在投资领域,TIL疗法也受到市场的青睐。在国内,自2017年以来,TIL疗法赛道融资超过30起,多家公司获得超过亿元的人民币投资,且多数融资发生在2020年后,随着TIL疗法进入到临床试验并且临床数据得到不断披露,效果也进一步得到验证,极大地鼓舞了市场以及投资者的信心。
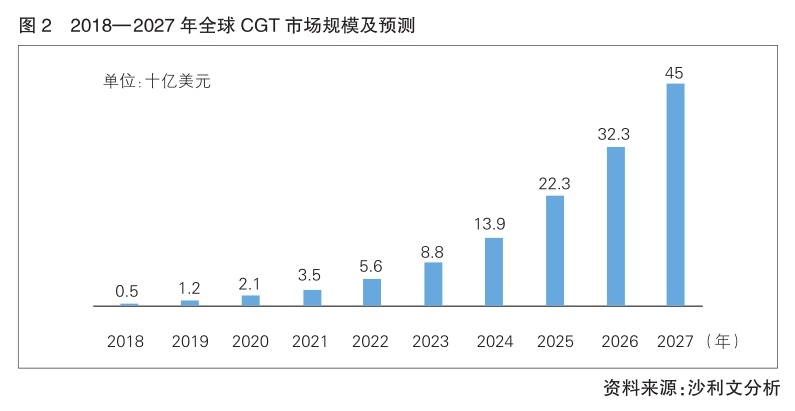
不仅是在中国,在全球范围内细胞疗法均受到广泛关注,并逐渐拓宽适应证领域,不仅在癌症治疗领域,在其他疾病领域也开始逐渐探索出新的治疗方式或治疗组合。细胞与基因治疗(CGT)领域在全球医疗健康产业中呈现出快速增长态势并体现出巨大的商业价值,市场规模持续增加。根据沙利文关于全球CGT治疗市场规模分析及预测报告,预计2023年全球CGT市场规模将达到88亿美元,2025年全球CGT市场规模将超过220亿美元(详见图2)。
随着科技不断突破及研发投入持续增长,细胞治疗技术将持续发展,其精准化、个性化治疗的优势也将得到更好的体现。未来,该市场将持续探索并满足未被充分满足的临床需求,进而显现出更加巨大的发展潜力和广阔的应用前景。
(作者:汪鹏)
 长按二维码
长按二维码关注精彩内容






